Folgewirkungen von Hitzestress in der Trockenstehperiode auf die Kuh selbst und ihr Nachkommen – Florida Studie Teil 2
Einleitung
Der Phänotyp wird von seinen Genen (fixiert in den zugehörigen DNA-Sequenzen) und epigenetischen Modifikationen beeinflusst.
Epigenetische Modifikationen können als Reaktion auf externe Umweltfaktoren oder interne Reize ausgelöst werden, ohne die DNA-Sequenz zu verändern.
Bei Nutztieren können solche Faktoren unter anderem Ernährung, sozialer Stress, Exposition gegenüber Krankheitserregern und/oder thermische Umweltfaktoren (z.B. Hitzestress) sein.
Epigenetische Veränderungen erleichtern die phänotypische Plastizität, indem sie den Phänotyp der Nachkommen beeinflussen und gleichzeitig einen festen Genotyp beibehalten.
Wenn epigenetische Markierungen von einer Generation zur nächsten (d. h. zwischen Generationen) weitergegeben werden, spricht man von intergenerationeller epigenetischer Vererbung. Wenn dieser Prozess über mehrere Generationen stattfindet, spricht man von transgenerationeller epigenetischer Vererbung (Laporta et al., 2024).
Derzeit gibt es nur begrenzte Belege für transgenerationelle Hitzestresseffekte auf phänotypischer Ebene. Nachfolgend soll über neueste Ergebnisse bezüglich eines kontinuierlichen Hitzestresses in der Spätträchtigkeit von Holstein-Kühen auf ausgewählte Phänotypen in der Töchter- bzw. Enkel-Generation berichtet werden.
Hitzestress während der Trächtigkeit kann eine intrauterine Hyperthermie bedingen, was zu kleineren Kälbern führt, die bei Erreichen der Geschlechtsreife weniger produktiv sind.

Weitere Ergebnisse aus der ‚Florida‘-Studie
Bei Säugetieren ist die fetale Temperatur bis zur Geburt von der Mutter abhängig, da der Fötus seine Temperatur nicht selbst regulieren kann. Die Körpertemperatur eines Rinderfötus liegt etwa 0,3 bis 0,5 °C über der Temperatur der Mutter. Gleichzeitig ist seine Stoffwechselrate pro Gewebegewicht im Vergleich zu der eines erwachsenen Rindes relativ hoch (Laporta et al., 2024).
In einer experimentellen Versuchsanstellung (= ‚Florida‘-Studie) mit Holsteinrindern an der University of Florida (USA) wurden Kühe (ca. 45 bis 60 Tage vor dem erwarteten Kalbetermin) planmäßig trockengestellt und für die Dauer der Trockenstehperiode zufällig einer von zwei Behandlungsgruppen zugewiesen:
- mit Hitzestress (= HT-Gruppe, hitzegestresst) oder
- mit Hitzestressminderung (= CT-Gruppe, ‚gekühlte‘ Gruppe) (vgl. Monteiro et al., 2014; Laporta et al., 2017, Dado-Senn et al., 2020 und 2021 u.a.)
Während der gesamten Trockenstehperiode (im Hochsommer Floridas) wurden beide Gruppen in einem schattigen Laufstall untergebracht; die CT-Gruppe hatte jedoch zusätzlich kontinuierlichen Zugang zu Wassersprühern und Ventilatoren. Dies hatte die HT-Gruppe nicht.
Zwischenzeitlich liegen nun auch erste, sehr interessante Ergebnisse aus den beiden Nachfolgegenerationen (Töchter- (= F1) und Enkelgeneration (= F2)) aus diesen in der Spätträchtigkeit differenziert gehaltenen Müttern (= F0-Generation) vor.
Phänotypische Beobachtungen in der Töchtergeneration
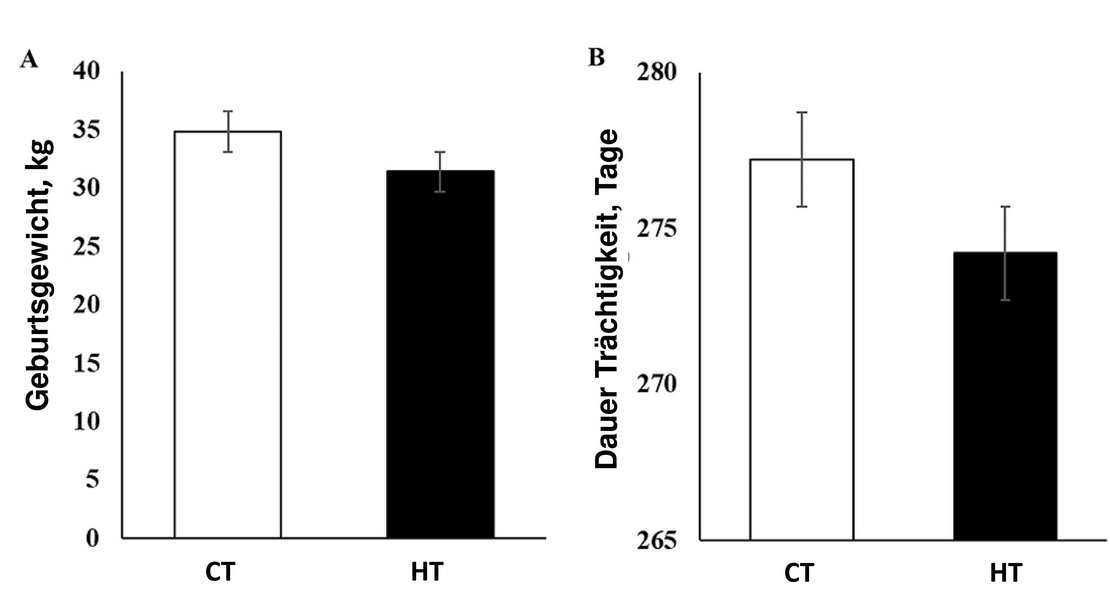
Holsteinkälber, die während der letzten 45 bis 60 Tage Hitzestress im Mutterleib (IUHS, ‚In-utero-hitzegestresst‘) ausgesetzt waren, wurden im Durchschnitt vier Tage früher geboren und erfuhren eine Wachstumsverzögerung (Abb. 1).
Abb.1:
- Weibliche Kälber, die von den HT-Muttertieren geboren wurden, waren bei der Geburt leichter (31,4 vs. 34,8 ± 1,59 kg)
- die Trächtigkeitsdauer bei den Tieren, die HT ausgesetzt waren, war geringer als bei den CT-exponierten Tieren (274,2 vs. 277,2 ± 1,46 d) während der Trockenstehzeit (54 ± 5 d)
Anmerkung: eigene Grafik in Anlehnung an die Daten von Casarotto et al. (2025) aus der ‚Florida‘-Studie
Das Immunsystem von Föten beginnt sich bereits in der Gebärmutter zu entwickeln. Es sollte deshalb nicht überraschen, dass ein häufiges und konsistentes Ergebnis eines IUHS darin besteht, dass neugeborene Milchkälber bei der Geburt eine verringerte Fähigkeit haben, Immunglobuline aus dem Kolostrum aufzunehmen (Nonnecke et al., 2012, Tao et al., 2012; Davidson et al., 2021).
Da der Fötus, speziell im 3. Trimester, ein schnelles Körper- und Organwachstum durchläuft, darf auch erwartet werden, dass die Exposition gegenüber Hyperthermie (in der Hochträchtigkeitsphase) erhebliche Auswirkungen auf die Entwicklung kritischer Organe hat. Hitzestress im Mutterleib führt bei F1-Kälbern zu einer kleineren Thymusdrüse und Milz sowie zu einer kleineren Leber einschließlich einem kleineren Herzen, während andererseits ihre Nebennieren tendenziell größer werden (Dado-Senn et al., 2021).
Wie andere sich entwickelnde Gewebe und Organe kann auch die Milchdrüse eine fetale Programmierung durchlaufen (Laporta et al., 2022).
Milchkühe, die einen IUHS durchlebten, haben kleinere Milchdrüsen als solche, die In-utero eine thermoneutrale Bedingung erfuhren (Dado-Senn et al., 2021).
Darüber hinaus weist das zugehörige Parenchymgewebe weniger duktale Epithelstrukturen mit deutlich weniger proliferierenden Zellen auf (Dado-Senn et al., 2022).
Diese phänotypischen ‚Fehlanpassungen‘ sind interessanterweise nicht auf Milchrinder beschränkt. So wurde gezeigt, dass auch die Föten von Schafen, die chronischem Hitzestress ausgesetzt waren, ähnliche maladaptive Phänotypen aufweisen.
Ähnlich wie oben erwähnt, sind IUHS-Schafföten typischerweise kleiner als ihre „thermoneutralen“ Counterparts (Limesand et al., 2018).
Auch zeigt sich, dass pränatale Hyperthermie über die frühen Lebensphasen hinaus anhaltende Auswirkungen auf die Nachkommen haben kann.
So produzieren Milchkühe, die einer pränatalen Hyperthermie ausgesetzt waren, weniger Milch. Dieser Rückgang der Milchproduktion ist teilweise auf Abweichungen in der Entwicklung der Milchdrüse während der Fötalphase zurückzuführen.
Die ‚Florida-Studie‘ zeigt, dass die durch pränatale Hyperthermie verursachten geringeren Milcherträge sogar bis mindestens zur dritten Laktation bestehen bleiben (Laporta et al., 2020). Außerdem werden pränatal hitzegestresste Tiere (F1-Tiere aus CT-Müttern) oft frühzeitig gemerzt (Laporta et al., 2020).
Phänotypische Belege für die zweite Generation
Während zahlreiche Studien über phänotypische Veränderungen in der 1. Nachkommengeneration (= F1-Tiere) berichten, die einen IUHS erlitten, gibt es nur sehr wenige Dokumentationen aus der 2. Nachkommengeneration (= F2-Tiere).
Die F2-Nachkommen sind die Enkelinnen derjenigen Kühe, die während ihrer Spätträchtigkeit unter Hitzestress litten (HT-Gruppe) bzw. eine Hitzestressminderung (CT-Gruppe) erfuhren. Mit anderen Worten: diese F2-Generation basiert auf Eizellen, die während ihrer Entwicklung im Inneren ihrer fetalen F1-Mütter intrauterinem Hitzestress (IUHS) ausgesetzt bzw. nicht ausgesetzt waren.
Die Fortführung der ‚Florida‘-Studie über mehrere Generationen ermöglichte nun auch eine erste Bewertung der Enkelinnen (Laporta et al., 2020).
Die Ergebnisse zeigen: Die F2-Tiere, die von einer pränatal hitzegestressten F1-Mutter abstammen, haben eine reduzierte Überlebensrate bis zum Absetzen bzw. bis zum Pubertätseintritt (= Merzung vor dem 12. Lebensmonat) (Laporta et al., 2020).
Aktuelle Daten belegen auch, dass die F2-Färsen, die aus einer hitzegestressten F1-Eizelle entstanden, am 70. Lebenstag (= eine Woche nach dem Absetzen) eine veränderte Mikrostruktur des Milchdrüsengewebes und einen veränderten Zellumsatz (d. h. reduzierte Proliferation von Milchepithelzellen und erhöhter Tod von Milchepithelzellen) aufweisen, verglichen mit F2-Färsen, die aus einer thermoneutralen F1-Eizelle entstanden (Larsen und Laporta, 2024).
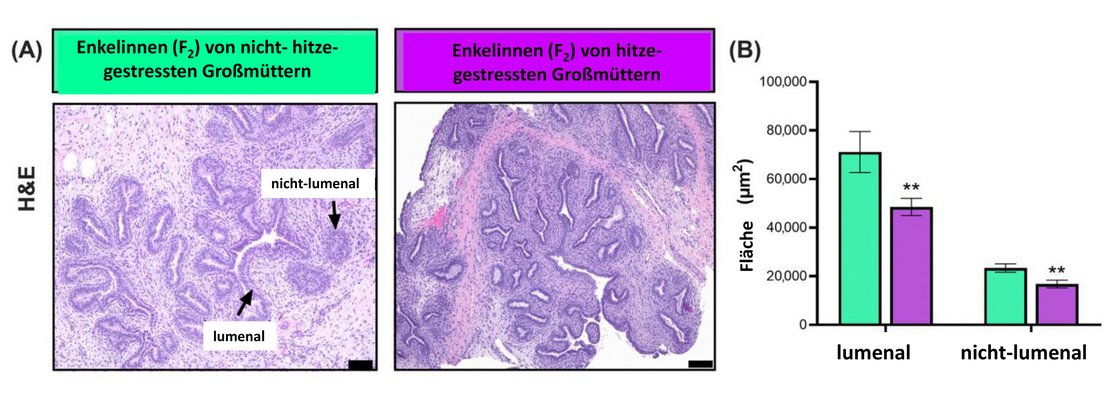
Milchdrüsenbiopsien wurden zur histologischen Bewertung der Epithelstrukturen (Hämatoxylin-Eosin-Färbung, H&E-Färbung) und zur Quantifizierung von Zellen entnommen, die beispielsweise positiv auf den Östrogenrezeptor, der α-Untereinheit (ERα) sind. Die lumenalen und nicht-lumenalen Epithelstrukturen im Milchdrüsenparenchym (PAR) von F2-Färsen aus HT-Großmüttern waren signifikant kleiner als die von F2-Färsen aus den CT-Großmüttern (Abb. 2).
Abb. 2: Histologische Bewertung der Mikrostruktur des Milchdrüsenparenchyms; basierend auf Milchdrüsenbiopsien von Jungtieren (in der 10. Lebenswoche) aus der zweiten Generation (F2) von Milchkühen (F1), die In-utero (letzte 56 ± 5 Tage im Mutterleib) Hitzestress bzw. kein Hitzestress ausgesetzt waren.
(A) Histologische Mikrofotografien von H&E-gefärbten Objektträgern bei 10-facher Vergrößerung.
(B) Die Bereiche der luminalen (= sichtbare Lumen) und nicht-luminalen (= keine sichtbaren Lumen) Epithelien-Strukturen wurden quantifiziert.
Mit anderen Worten: Hitzestress in der Spätträchtigkeit scheint versteckte, generationsübergreifende Effekte zu erzeugen, die dazu beitragen, dass HT-F2-Färsen mit physiologischen Nachteilen in die Laktation eintreten.
Beobachtete Anpassungen der Haut- und Haarmorphologie in der F2-Generation
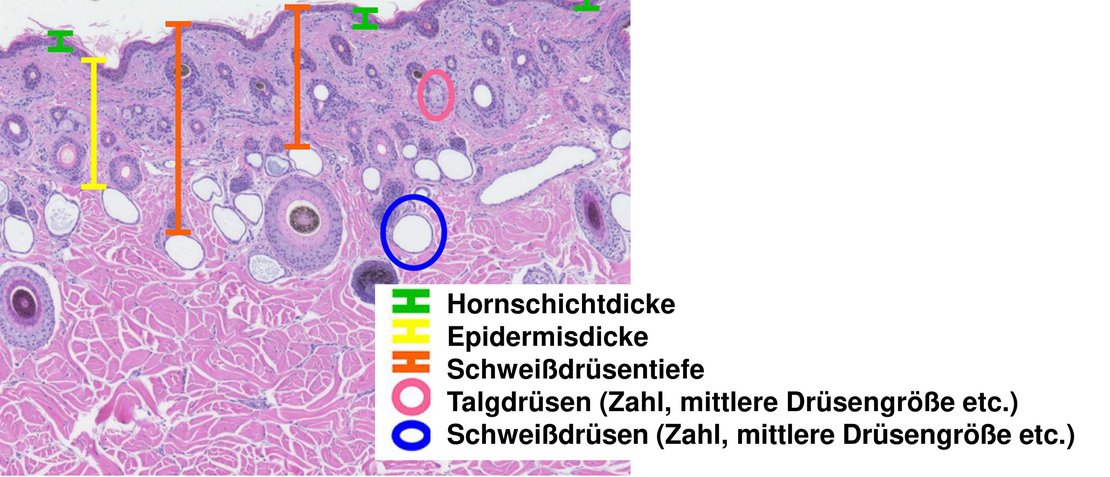
Homöostase und Thermoregulation werden auch durch das Zusammenspiel von Haarkleid und Hauteigenschaften beeinflusst.
Der Beginn des Haarfollikelwachstums bei Rindern beginnt bereits am 77. Trächtigkeitstag im Mutterleib; Haare beginnen dem Fötus nach ca. 200 Tagen zu sprießen.
In einer weiteren Analyse im Rahmen der ‚Florida‘-Studie wurde außerdem untersucht, ob IUHS auch in der Enkelinnen-Generation (F2-Tiere) noch Haar- und Hautanpassungen auslöst (Davidson et al., 2023).
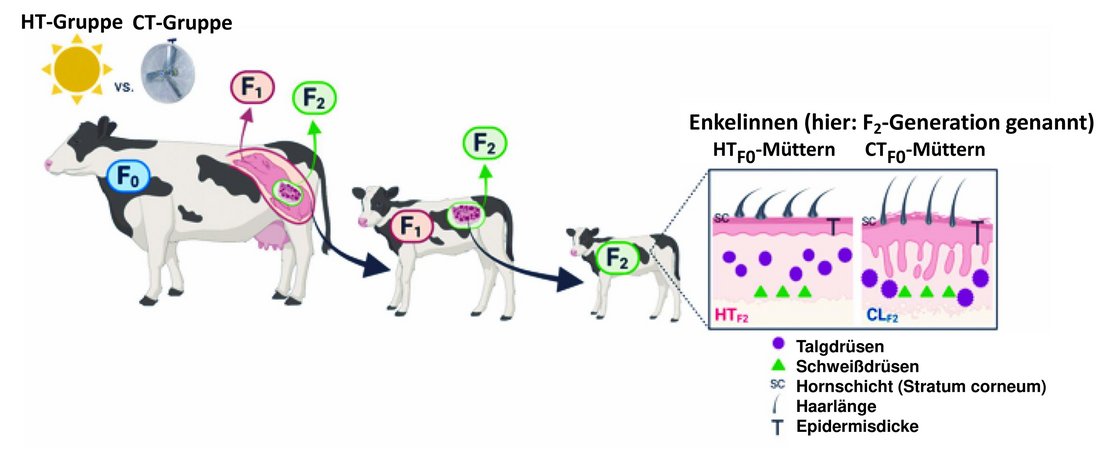
Das zugehörige Versuchsdesign ist in der Abbildung 3 aufgezeigt.
Abb. 3: Versuchsdesign: in den letzten 56 Trächtigkeitstagen wurden hochtragende Holstein-Muttertiere (‚spätere‘ Großmütter; hier: F0-Generation genannt, n = 82) einem permanenten Hitzestress ausgesetzt (HT-Gruppe) bzw. erhielten Hitzestressminderung (CT-Gruppe).
Die Nachkommen dieser F0-Kühe (= ihre Töchter; F1-Generation, n = 73) erfuhren somit bereits im Mutterleib Hitzestress (HT-Töchter) oder auch nicht (CT-Töchter).
Die erzeugten Töchter (= F1-Tiere) wurden von der Geburt bis zum ersten Kalben gleichbehandelt.
Von den daraus wiederum erzeugten Tieren (= Enkelinnen; F2-Tiere) wurden im Alter von 70 Tagen Haarproben und Hautgewebebiopsien entnommen und weiter analysiert
Verschiedene Haar- und Hautmaße (d. h. Haarlänge und -durchmesser, Dicke des Hornschicht, Dicke der Epidermis, Tiefe, Anzahl und Größe der Schweißdrüsen bzw. Anzahl und Größe der Talgdrüsen) wurden ausgewertet (Abb. 4).
Ergebnisse:
- im Alter von 70 Tagen hatten HT-F2-Färsen im Vergleich zu CL-F2-Färsen kürzere Haare
- der Haardurchmesser war bei den
- in weiteren Hauthistomorphologie-Merkmalen zeigen sich ebenfalls Unterschiede (Abb. 5):
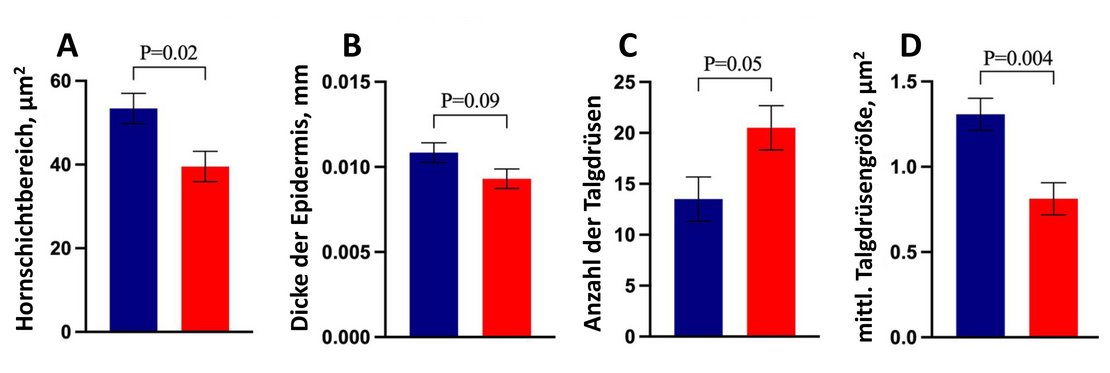
- der Hornschicht-Querschnittsbereich der Haut war kleiner (39,54 vs. 53,41 HT-F2 vs. CL-F2)
- die Epidermisdicke war bei den HT-F2-Färsen im Vergleich zur CL-F2-Gruppe tendenziell dünner
- Stratum corneum-Dicke, Schweißdrüsen-Tiefe, Schweißdrüsen-Anzahl, Schweißdrüsen-Querschnittsbereich, Schweißdrüsen-Durchschnittsgröße und Talgdrüsen-Querschnittsbereich unterschieden sich nicht
- die Talgdrüsen waren bei den HT-F2-Färsen zahlreicher und die mittlere Talgdrüsen-Größe kleiner als bei den CL-F2-Färsen
Abb. 5: Zu den signifikant unterschiedlichen Hauthistomorphologie-Merkmalen gehörten der Querschnittsbereich der Hornschicht (A), die Dicke der Epidermis (B), die Anzahl der Talgdrüsen (C) und die durchschnittliche Talgdrüsengröße (D)
Anmerkung: blaue Säulen: CL-F2-Gruppe; rote Säulen: HT-F2-Gruppe (modifizierte eigene Grafik in Anlehnung an Davidson et al., 2023)
Zusammenfassend lässt sich festhalten, dass sogar Haar- und Hautanpassungen bei Enkelinnen von Holstein-Milchkühen, die im Mutterleib Hitzestress ausgesetzt waren, dokumentiert werden konnten.
Hitzestress ist im Allgemeinen mit negativen Auswirkungen auf die Nahrungsaufnahme, Gesundheit und Leistung assoziiert. Ergebnisse epidemiologischer und experimenteller Studien zeigen, dass längerfristiger Hitzestress in der Spätträchtigkeit von Milchkühen den Phänotyp der Nachkommen auf verschiedene Weise beeinflusst. So ist Hitzestress im Mutterleib beispielsweise mit einem geringeren Körpergewicht bei der Geburt und Veränderungen der Stoffwechsel- und Immunfunktionen des Kalbes verbunden.
Bei Rindern können die Auswirkungen von Hitzestress auf die Leistungsfähigkeit der Nachzucht scheinbar mehrere Generationen anhalten, was auf generationsübergreifende Auswirkungen hindeutet. Der molekulare Mechanismus, der diese Auswirkungen von Hitzestress determiniert, dürfte eine epigenetische Regulierung sein.
DER DIREKTE DRAHT
Prof. Dr. habil. Wilfried Brade,
Professor i.R.,
TiHo Hannover und Norddeutsches Tierzucht-Beratungsbüro
E-Mail: wilfried.brade[at]t-online.de
Literatur (wird nicht gedruckt, steht aber bei Bedarf zur Verfügung)