M.Sc. Susanne Velten und Prof. Dr. Frank Liebert von der Georg-August-Universität in Göttingen, befassen sich im aktuellen Beitrag mit der Frage, ob das Insektenmehl von Larven der schwarzen Soldatenfliege (Hermetia illucens) aus ernährungsphysiologischer Sicht geeignet ist, einen beachtlichen Anteil des Sojaextraktionsschrotes im Futter für Mastschweine und Hähnchen zu ersetzen. Verfolgt man die aktuellen internationalen Forschungsaktivitäten, so wird zunehmend das Bestreben sichtbar, auch über Insektenmehle zum teilweisen Austausch des traditionell genutzten Sojaextraktionsschrotes (SES) in der Ernährung der Monogastride beizutragen. Die Nutzung von Insekten als Proteinquelle ist aufgrund mehrerer Vorteile interessant.
Larven der schwarzen Soldatenfliege (Hermetia illucens) als potentieller Proteinlieferant in der Schweine- und Geflügelernährung
Verfolgt man die aktuellen internationalen Forschungsaktivitäten, so wird zunehmend das Bestreben sichtbar, auch über Insektenmehle zum teilweisen Austausch des traditionell genutzten Sojaextraktionsschrotes (SES) in der Ernährung der Monogastride beizutragen. Der Literatur können bereits umfangreiche Hinweise zum Einsatz von Insekten verschiedener Arten, Entwicklungsstadien und Aufbereitungsformen in der Geflügel-, Fisch-, Schweine- und Heimtierernährung entnommen werden. Bei diesen Tierarten können Insekten auch eine natürliche Proteinquelle darstellen. Die Nutzung von Insekten als Proteinquelle ist aufgrund mehrerer Vorteile interessant. Die Reproduktionsgeschwindigkeit ist sehr hoch und die Substratverwertung liegt bei sehr geringem Flächenbedarf auf hohem Niveau. Aktuell kann das größte Potential für eine industrielle Erzeugung von Insekten als Futtermittel bei schwarzer Soldatenfliege, Hausfliege und Mehlwurm gesehen werden. Dieser Beitrag konzentriert sich primär auf die Larven der schwarzen Soldatenfliege (Hermetia illucens), da diese Insektenart Gegenstand aktuell bearbeiteter Forschungsprojekte unserer Einrichtung ist.
Futtermittelrechtliche Rahmenbedingungen
Futtermittelrechtlich besteht international aktuell keine einheitliche Regelung für Insekten als Futtermittel, hier kann nur auf die gegenwärtige Situation in der EU eingegangen werden. Für Insekten als Futtermittel ist eine Zuordnung zum Komplex „verarbeitete tierische Proteine“ von Nutzinsekten erfolgt. Demnach sind die Soldatenfliege (Hermetia illucens), Hausfliege (Musca domestcia), Mehlwurm (Tenebrio Molitor und Alphitobius diaperinus) sowie drei Grillarten (Acheta domesticus, Gryllodes sigillatus, Gryllus assimilis) als geeignet eingeordnet worden (Commission Regulation (EU) 2017/893). Unter Einhaltung einer Reihe von Bedingungen sind diese Nutzinsekten seit dem 01.07.2017 für den Einsatz im Fischfutter zugelassen. Zu den wesentlichen Bedingungen zählt, dass nur Futtermittel als Ernährungsgrundlage für die zu verarbeitenden Insekten zulässig sind. Demnach sind Proteine von Wiederkäuern, Abfälle des Gastronomie- und Lebensmittelhandels sowie Exkrete jeder Art untersagt. Dies gilt gleichermaßen für Importprodukte. Ausschließlich erlaubt sind Blutprodukte, Gelatine, Kollagene sowie hydrolysierte Proteine von Nichtwiederkäuern, Eier und Eiprodukte, Milch, Milchprodukte, Kolostrum sowie hydrolysierte Proteine von Häuten, Fellen, Hufen von Wiederkäuern. Ansonsten ist grundsätzlich das Spektrum der geeigneten Futtermittel zugelassen.
Die schwarze Soldatenfliegenlarve (Hermetia illucens)-Biologie und Erzeugung
Die Soldatenfliege durchläuft fünf Entwicklungsphasen, das Ei-, Larven-, Vorpuppen-, Puppen und Erwachsenenstadium. Sie zählt demzufolge zu den holomethabolen Insekten, die eine vollständige Metamorphose durchlaufen. Die Larven sind nach dem Schlupf zunächst weiß-gelblich gefärbt, ihr Farbton wandelt sich jedoch mit fortlaufender Entwicklung wie in Abbildung 1 dargestellt. In dem Entwicklungszeitraum können die Larven eine Länge von 27 mm und einen Durchmesser von 6 mm erreichen.

Unmittelbar nach dem Schlupf nutzen die Larven die umgebende organische Masse als Nahrungsquelle. Die Dauer des Larvenstadiums währt etwa 4 bis 5 Wochen, abhängig von der Futterverfügbarkeit. Sollen Soldatenfliegenlarven gezüchtet werden, müssen zahlreiche Anforderungen erfüllt werden, die wichtigsten Rahmenbedingungen sind nachfolgend genannt:
- Eine Umgebungstemperatur von 27 °C - 30 °C
- Bei mehr als 1000 Larven pro Aufzuchtbox entstehen hohe Temperaturen (über 50 °C ist möglich), eine gute Belüftung ist deshalb erforderlich
- Als Nahrungsquelle sind diverse organische Materialien denkbar, jedoch müssen die futtermittelrechtlichen Vorgaben eingehalten werden
- Der hohe Futterbedarf der Larven muss beachtet werden. Da sie bis zu 50 % des Futters in neue Körpermasse umsetzen, muss stets genug Futter vorhanden sein um das schnelle Wachstum zu begünstigen
- Das Futter- bzw. Aufwuchssubstrat sollte saugfähig sein, da die Larven Stoffwechselprodukte und Flüssigkeiten abgeben
- Im Vorpuppenstadium besteht zunehmend das Bestreben das Substrat zu verlassen, dies ist der geeignete Zeitpunkt zum Absammeln / Absieben der Larven für die weitere Verarbeitung

Ernährungsphysiologische Eigenschaften
Die Larven der Soldatenfliege weisen einen Rohprotein-Gehalt von ca. 44 % in der Trockenmasse (T) auf, wobei dieser je nach Entwicklungsstand, Futtersubstrat und Grad der Entfettung deutlich schwanken kann. Wie in Tabelle 1 dargestellt, variieren die Gehalte an Hauptnährstoffen in Abhängigkeit der Verarbeitungsstufe, die sich hauptsächlich aus einem differenzierten Grad der Fettabtrennung ergibt. Die Proteinqualität kann in einem ersten Schritt auf Basis des AS-Profils bewertet werden. Ausgenommen die schwefelhaltige AS Cystein, weisen Insektenproteine ähnliche AS-Relationen wie Sojaprotein auf. Der Fettgehalt der Larven variiert je nach Größe und Entwicklungsstadium, er kann mit fortlaufendem Alter von 13 % auf 40 % ansteigen. Am stärksten repräsentiert sind die gesättigten Fettsäuren in der Larve, mit ca. 42 % der gesamten Fettsäuren weist die Laurinsäure einen überproportional hohen Anteil auf. Die Fettsäurezusammensetzung der Larve kann durch das Futtersubstrat beeinflusst werden. Enthält das Substrat hohe Gehalte an Omega-3-Fettsäuren, erhöht sich auch der Gehalt an Omega-3-Fettsäuren in den Larven. Das gilt z.B. für die gesundheitsfördernde Eicosapentaensäure (EPA) und Docosahexaensäure (DHA). Aus Sicht der Verarbeitungs- und Lagerungseigenschaften von Insektenmehlen, ist eine Teilentfettung sinnvoll.


Fütterungsversuche an Mastschweinen und Hähnchen
Im Rahmen des vom Niedersächsischen MWK geförderten Projektes „Sustainability Transitions: Alternative Proteinquellen in sozio-technischer Perspektive“ werden aktuell in unserer Forschungsgruppe u.a. die Einsatzbedingungen von Hermetia Mehl bei Monogastriden untersucht. Das untersuchte Hermetia Mehl, wurde von einem kommerziellen Hersteller (Hermetia Futtermittel GbR, Baruth/Mark, Deutschland) bezogen. Die Larven wurden nach 20 Masttagen vom Futtersubstrat (Roggenmehl, Weizenkleie) getrennt und bei 65 °C – 70 °C für 14 Stunden getrocknet. Anschließend wurde mit einer Schneckenpresse eine Teilentfettung und weiter eine Vermahlung vorgenommen. Die analysierten Nährstoffgehalte dieser Proteinquelle im Vergleich zum verwendeten SES können Tabelle 2 entnommen werden.
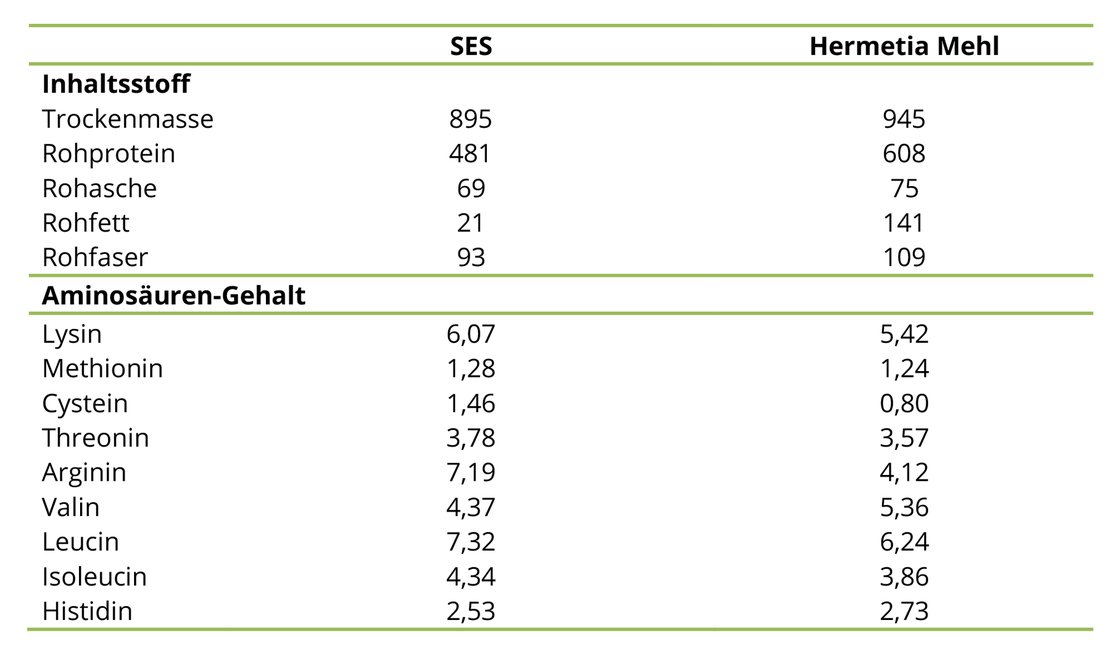
In der Abbildung 2 finden sich die AS-Gehalte der beiden Proteinquellen im Vergleich, die die zu erwartenden Defizite bei der Substitution von SES durch Hermetia Mehl erkennen lassen. Dabei fallen besonders die defizitären Gehalte für Lysin, Cystein, Arginin und Leucin ins Auge.
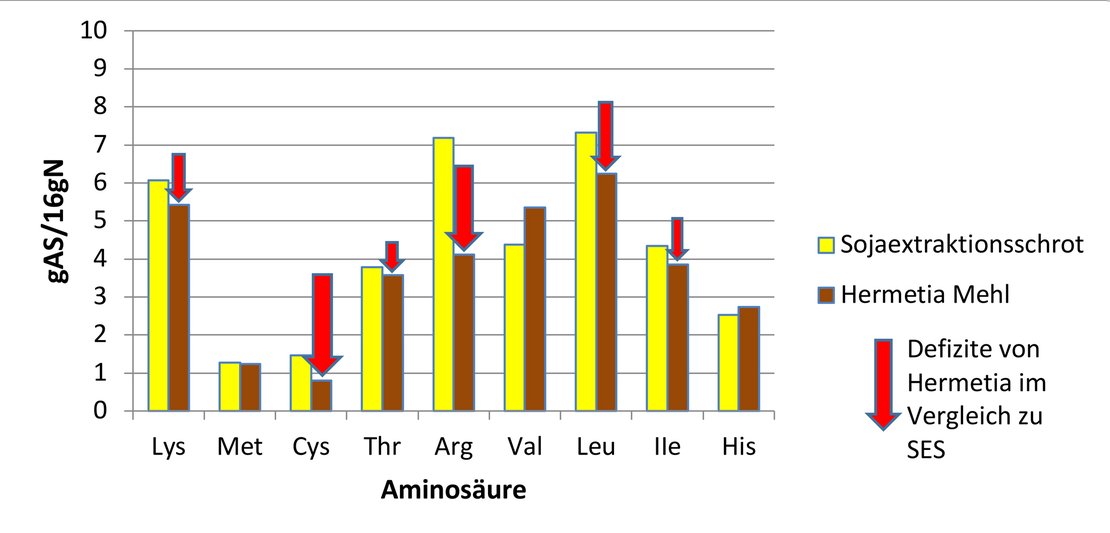
Der Schwerpunkt aktueller Tierexperimente lag bei den Substitutionsmöglichkeiten von SES durch Insektenmehl, insbesondere die Voraussetzungen für hohe Anteile an Hermetia Mehl im Futter von wachsenden Schweinen und Masthähnchen wurden getestet. Sowohl Wachstums- als auch Stickstoffbilanzversuche mit Ferkeln, Mastschweinen und Masthähnchen wurden durchgeführt. Das Austauschniveau von SES durch Insektenmehl lag gestaffelt bei 50 %, 75 % und 100 %, wobei unterschiedliche Supplementationsgrade an Futteraminosäuren zur Anwendung kamen. Nachfolgend werden erste Teilergebnisse zusammenfassend dargestellt.
In Abbildung 3 sind ausgewählte Ergebnisse der Fütterungsversuche mit Ferkeln [PIC 408 x (Large White x Landrace)] dargestellt.
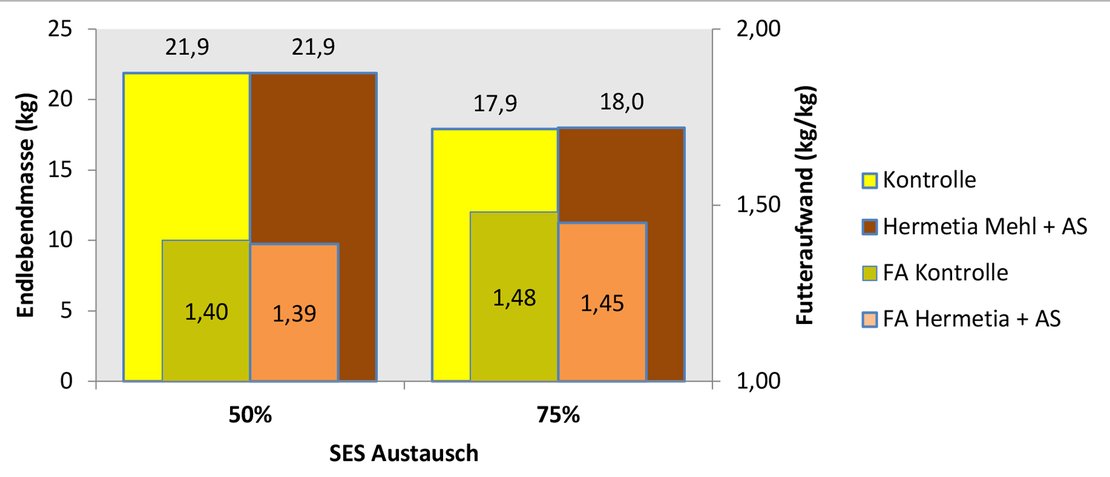
Die Ferkel erhielten als Absetzer nach einer 14-tägigen Gewöhnungsphase die zu vergleichenden Versuchsmischungen. Sowohl bei einem 50 %igen (25 Versuchstage) als auch bei einem 75 %igen (21 Versuchstage) Austausch von SES gegen Hermetia Mehl zeigten sich bei Einhaltung optimaler AS-Relationen durch AS-Zulagen in den Mischungen keinerlei Unterschiede in den Endlebendmassen und beim Futteraufwand. Wurden die Mischungen nicht entsprechend den Anforderungen der Tiere mit AS-Zusätzen ausgeglichen (hier nicht dargestellt), verschlechterten sich die zootechnischen Ergebnisse tendenziell gegenüber der Kontrollmischung.
Weiterführende Untersuchungen in einem Mastbereich bis ca. 75 kg Lebendmasse ergaben vergleichbare Ergebnisse.
Einige Ergebnisse der parallel durchgeführten Untersuchungen mit Masthähnchen (Ross 308, Mastdauer 34 Tage) zeigt Abbildung 4.
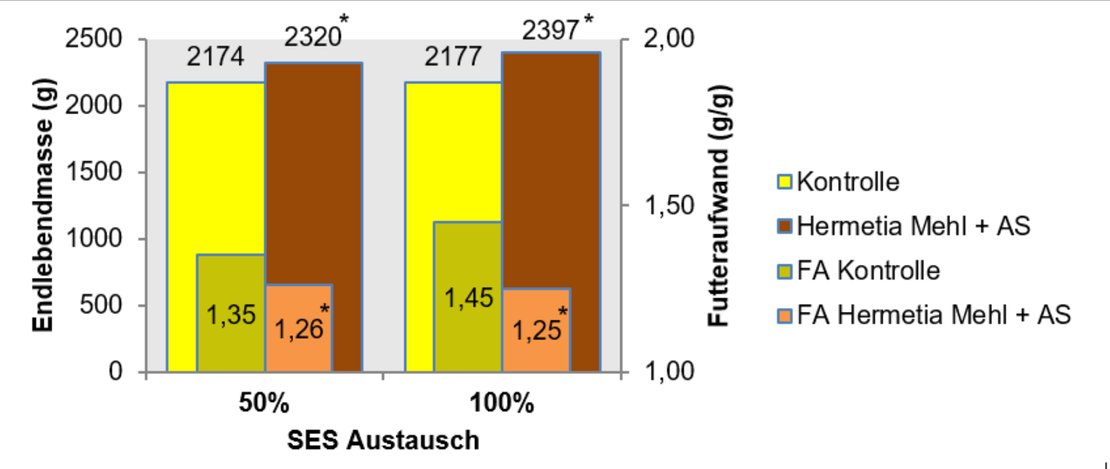
Die Ergebnisse nach 50 %igem und 100 %igem Austausch von SES in der Futtermischung bei angepasster AS-Supplementierung zeigen eindrucksvoll für beide Austauschniveaus signifikant bessere Werte für die Hermetia-Gruppe.
Auch unsere N-Stoffwechselversuche ergaben (hier nicht dargestellt), dass Mischungen mit hohem Anteil an Hermetia Mehl bei entsprechender AS-Supplementierung eine vergleichbar gute Proteinqualität aufweisen können wie Futtermischungen mit SES als Hauptproteinträger. Eine passgenaue Ergänzung mit kristallinen AS ist demnach eine zielführende Voraussetzung für hohe Mischungsanteile an Insektenmehl.
Mögliche Einsatzgrenzen und Besonderheiten
Wie bereits dargestellt, muss im Insekten-Mehl, insbesondere die Limitierung durch die schwefelhaltigen AS beachtet werden. Ohne entsprechenden Ausgleich sind Einsatzbeschränkungen zu erwarten.
Hinzu kommt die Vermutung, dass der den Larvenkörper umgebende Chitin-Anteil einsatzbegrenzend sein könnte. Aus bisherigen vorläufigen Daten kann zwar abgeschätzt werden, dass vollfette Hermetia Mehle etwa 4 – 6 % Chitin enthalten, allerdings fehlen aufgrund der anspruchsvollen Chitin-Analytik zuverlässige Vergleichsdaten. Durch die angestrebte Teilentfettung wird dieser Wert in etwa verdoppelt. Studien zeigten, dass hohe Konzentrationen (bis zu 45 %) von Chitin sowohl die Futteraufnahme als auch die Proteinverdaulichkeit bei Hühnern negativ beeinflussen können. Allerdings kann dieser Faktor bei realistischem Mischungsanteil von Insektenmehl nicht als erstrangig eingeordnet werden.
Eine weitere Herausforderung bilden die Transferfragen vom Substrat in die Insektenlarve. Potenzielle biologische (Bakterien, Viren, Parasiten, Pilze etc.) und chemische Risiken (Schwermetalle, Toxine, Hormone etc.) der aus Insekten gewonnenen Lebens- und Futtermittel hängen von verschiedenen Faktoren ab. Dazu gehören die Produktionsverfahren, die Nahrung der Insekten, die jeweilige Lebenszyklusphase sowie die Verarbeitungsmethoden. Es ist jedoch anzunehmen, dass, wenn die futtermittelrechtlichen Vorgaben eingehalten werden, kein erhöhtes Gefahrenpotential besteht. Zu diesen wichtigen Fragen bestehen aber nach wie vor erhebliche Informationsdefizite, die schrittweise aufgeklärt werden müssen.
Fazit
Die ersten Forschungsergebnisse und Literaturbefunde zeigen deutlich, dass Insektenmehl von Hermetia illucens aus ernährungsphysiologischer Sicht geeignet ist, einen beachtlichen Anteil des Sojaextraktionsschrotes im Futter für Mastschweine und Hähnchen zu ersetzen. Immer vorausgesetzt, dass die Insektenmehle eine futtermittelrechtlich Zulassung erhalten. Aus Sicht der Akzeptanz, Kombinationseignung sowie der Produktqualität bestehen bei Insektenmehlen wenige Beschränkungen in der möglichen Einsatzhöhe. Inwieweit eine wirtschaftlich interessante Erzeugung von qualitativ hochwertigen Insektenmehlen möglich ist, wird die Zukunft zeigen.
Weitere Informationen über das Forschungsprojekt „sustainability transitions“ finden sie hier.
DER DIREKTE DRAHT
M.Sc. Susanne Velten und Prof. Dr. Frank Liebert
Georg-August-Universität Göttingen,
Abteilung Tierernährungsphysiologie,
37077 Göttingen
Stand: Juli 2018
Literatur
Caruso, D., Devic, E., Submia, I.W., Talamond, P. and Baras E. (2014). Technical handbook of domestication and production of diptera Black Soldier Fly (BSF) Hermetia illucens , Stratiomyidae. Bogor (IDN) ; Marseille : IPB Press ; IRD. horizon.documentation.ird.fr/exl-doc/pleins_textes/divers17-11/010063336.pdf
Kortelainen, T., Siljander-Rasi, H., Tuori, M., Partanen, K. (2014). Ileal digestibility of amino acids in novel organic protein feedstuffs for pigs: Black soldier fly larvae meal (Hermetia illucens). Agrifood Research Finland. jukuri.luke.fi/bitstream/handle/10024/532273/Hermetia.pdf;
Makkar, H. P. S.; Tran, G.; Heuzé, V.; Ankers, P., 2014. State-of-the-art on use of insects as animal feed. Animal Feed Science Technology, 197: 1-33. doi.org/10.1016/j.anifeedsci.2014.07.008
Neumann, C., Velten, S. and Liebert, F. (2018) Improving the Dietary Protein Quality by Amino Acid Forification with a High Inclusion Level of Micro Algae (Spirulina platensis) or Insect Meal (Hermetia illucens) in Meat Type Chicken Diets. Open Journal of Animal Sciences, 8, 12-26. doi.org/10.4236/ojas.2018.81002
Neumann, C., Velten, S. and Liebert, F. (2018). The Graded Inclusion of Algae (Spirulina platensis) or Insect (Hermetia illucens) Meal as a Soybean Meal Substitute in Meat Type Chicken Diets Impacts Growth, Nutrient Deposition and Dietary Protein Quality Depending on the Extent of Amino Acid Supplementation. Open Journal of Animal Sciences, 8, 163-183. doi.org/10.4236/ojas.2018.82012
Velten, S., Neumann, C., Bleyer, M., Gruber-Dujardin, E. Hanuszewska, M., Przybylska-Gornowicz, B. and Liebert, F. (2018) Effects of 50 Percent Substitution of Soybean Meal by Alternative Proteins from Hermetia illucens or Spirulina platensis in Meat-Type Chicken Diets with Graded Amino Acid Supply. Open Journal of Animal Sciences, 8, 119-136. doi.org/10.4236/ojas.2018.82009
